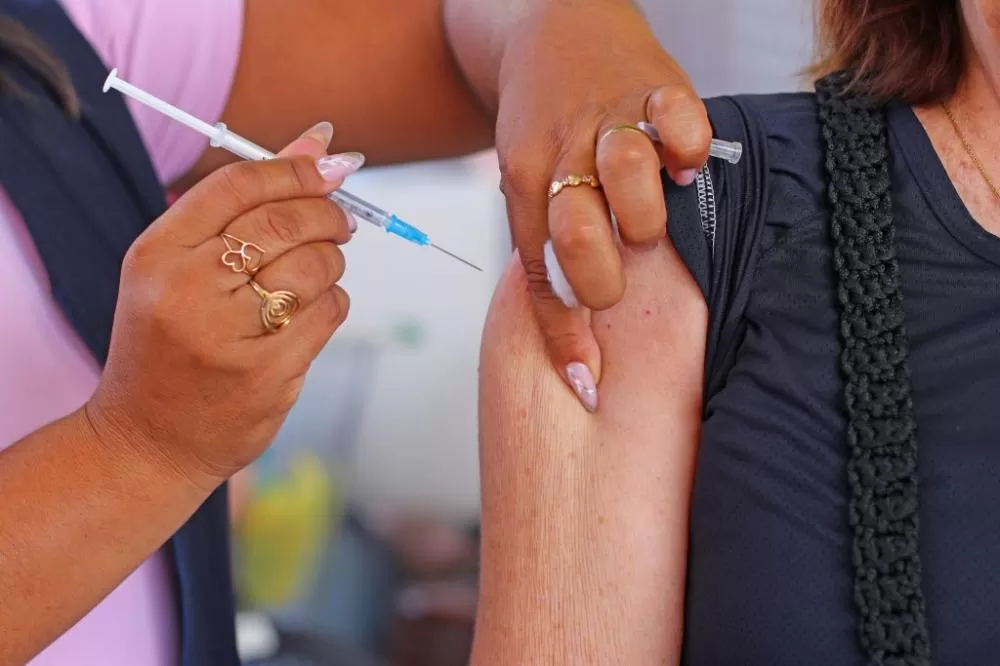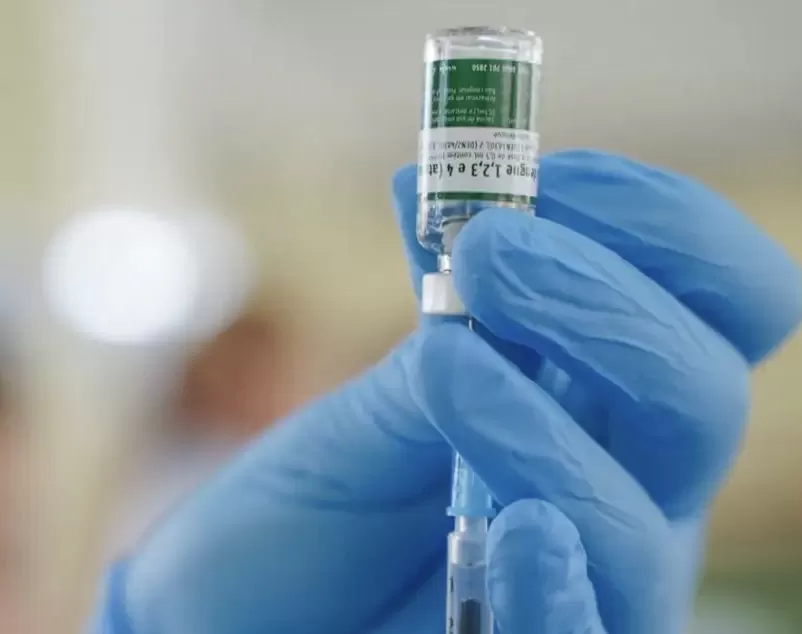
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou o registro do Leqembi, novo medicamento indicado para o tratamento de Alzheimer em fase inicial. A autorização foi oficializada no último dia 22 de dezembro. Apesar da liberação, ainda não há previsão para o início da comercialização no país.
O remédio é destinado a pacientes adultos já diagnosticados com comprometimento cognitivo leve ou demência inicial causada pelo Alzheimer. Ele será disponibilizado em ampolas e a aplicação deve ocorrer por via intravenosa, a cada duas semanas.
O Leqembi atua na redução das placas beta-amiloides no cérebro, partículas de proteína consideradas um dos principais fatores associados ao desenvolvimento da doença.
A eficácia foi comprovada em um estudo que acompanhou 1.975 pacientes com Alzheimer em estágio inicial. Parte deles recebeu o medicamento e outra parte, placebo. Após 18 meses, os pacientes tratados com Leqembi apresentaram evolução mais lenta da doença: 1,22 ponto na escala CDR-SB, contra 1,76 entre os que receberam placebo.
Antes do início do tratamento, os pacientes devem realizar o teste para o gene ApoE4, principal variante genética associada ao risco de Alzheimer.
Os melhores resultados foram observados em pessoas com apenas uma ou nenhuma cópia do gene. Já pacientes com duas cópias apresentaram maior risco de efeitos colaterais graves, como inchaços e sangramentos no cérebro. Por isso, o uso do medicamento não é recomendado para esse grupo.
A expectativa agora é pela definição sobre quando o medicamento estará disponível para venda no Brasil.